Ab initio predicted spincrossover (SCO) transitions in a FeNb... Download Scientific Diagram
What is the hybridisation of [Co(H2O)6+3] I have heared that H20 behaves like a strong ligand in

La diferencia es: ΔE = ls — hs = 6π e - 5π e = π e. 4. Dado el valor de Δ o y π en cada caso, prediga si el complejo será de alto giro o de giro bajo. a) [Mn (OH 2) 6] 2+. Δ o = 7,500 cm -1 y π = 25,500 cm -1; debido a que cuesta más emparejar electrones que promover uno, este complejo será de alto giro.
Ground and Excited States of the [Fe(H2O)6]2+ and [Fe(H2O)6]3+ Clusters Insight into the

El níquel (II) forma C octaédricos de orbital externo con L como el NH3 y el H2O, sin embargo con L fuertes, como el CN-, forma C planos diamagnéticos que implican enlaces dsp2. Los C planos son también comunes para el. Pd(II), Pt(II), Cu(II) y Au(III). Número de coordinación 2. Estructura lineal: hibridación spd.
38. The total CFSE for [ Co(H2O6)] 3+ and [CoF6]3 are respecitvely ( P is the
Síntesis de los complejos [Co(H₂O)(NH₃)₅]Cl₃, [CoCl(NH₃)₅]Cl₂, [Co(κO-NO₂)(NH₃)₅]Cl₂ y [Co(κN-NO₂)(NH₃)₅]Cl₂. Material.. (III) son de bajo spin y diamagnéticos, dado su alto estado de oxidación (indica campo fuerte). Se comprobará mediante medidas espectroscópicas en la franja del (VIS-UV) que realmente.
(PDF) Electron spin relaxation of vibronic Cu(H2O)6 complexes in K2Zn(SO4)2·6H2O single crystals

para los siguientes iones complejos de cromo:! complejo [CrF6]3- [Cr(H2O)6]3+ [CrF6]2- 3[Cr(CN)6] - Δ0 (cm-1) 15000 17400 22000 26600 Ejercicios Tema 7. Química de Coordinación • Solución:!! III3 complejos de Cr y 1 complejo de CrIV!! IIIi) Complejos de Cr :! - Los valores de Δ 0 están de acuerdo con lo esperado, teniendo en cuenta la
Coordinación química compleja química compuesto octaédrico geometría molecular isómero, óxido de

Complejos de alto y bajo espín Prediga el número de electrones desapareados. (a) K 3 [CrI 6] (b) [Cu(en) 2 (H 2 O) 2]Cl 2 (c) Na 3 [Co(NO 2) 6] Solución Los complejos son octaédricos. (a) Cr 3+ tiene una configuración d 3. Estos electrones estarán todos sin aparear. (b) El Cu 2+ es d 9, por lo que habrá un electrón no apareado.
modelo de química de la molécula de agua h2o elementos científicos. partículas integradas de
Holleman/Wiberg states (translation by me) $\ce{Co^{3+}}$ usually forms octahedral low-spin complexes, because it is the only way to achieve a high ligand-field stabilization energy. Octahedral high-spin complexes are typically an exception; they are formed with the "weakest" ligands (fluoride): $\ce{[CoF6]^{3-}}$, $\ce{[CoF3(H2O)3]}$ (the ion $\ce{[Co(H2O)6]^{3+}}$ is in the low-spin state).
(PDF) Electron spin relaxation of vibronic Cu(H2O)6 complexes in K2Zn(SO4)2·6H2O single crystals

Los tres electrones se llenarían spin-up en el orbital t 2g siguiendo la regla de Hund (Figura \(\PageIndex{4}\)). Debido a que cada electrón tiene el espín +1/2, el espín total de los tres electrones es 3x1/2=3/2.. Para el complejo de alto espín no existe otro término sexteto, lo que significa que no hay transición electrónica.
High Spin and Low Spin Complexes Chemistry LibreTexts
Equilibrio de espín. El equilibrio de espín se puede dar en un sistema extendido, cuando son posibles dos fases magnéticas. Típicamente, el momento magnético lo aportan metales de transición. Según su población electrónica, algunos metales de transición pueden presentar estado de alto espín o de bajo espín, y se encuentran en uno u.
CFT Stability of Complex [Fe(,H2O)6]3+/High spin/TN/12th Chemistry/Unit 5/Coordination

Tomando como ejemplo un complejo de alto spin, por ejemplo un d 4 (t 3 2g e 1 g), el cuarto electrón d puede ocupar el orbital dx²-y² o el dz² con igual energía. Si el orbital d x²-y² está ocupado, se rechazan los 4 ligandos ecuatoriales, lo que da como resultado la compresión del octaedro.
High Spin and Low Spin Complexes

6] 2+. La adición de ligandos a la disolución acuosa permite la formación de complejos por el sucesivo desplazamiento de moléculas de agua. En el caso del amoniaco, por ejemplo, las moléculas de NH 3 desplazan a moléculas de agua hasta formar [Cu(NH 3) 4 (H 2 O) 2] 2+, pero la adición de la quinta y sexta moléculas de NH 3 no se produce
Estrutura De Lewis H2o ENSINO
Bearing four acetate groups (π-donor ligands) and two amino groups ( σ-donor only ligands) we would expect EDTA to form high-spin complexes with M 2+ and M 3+ metals of the first transition series. However, in the case of Co (III) we would expect a low-spin complex. For metals of the second and third transition series, we would expect.
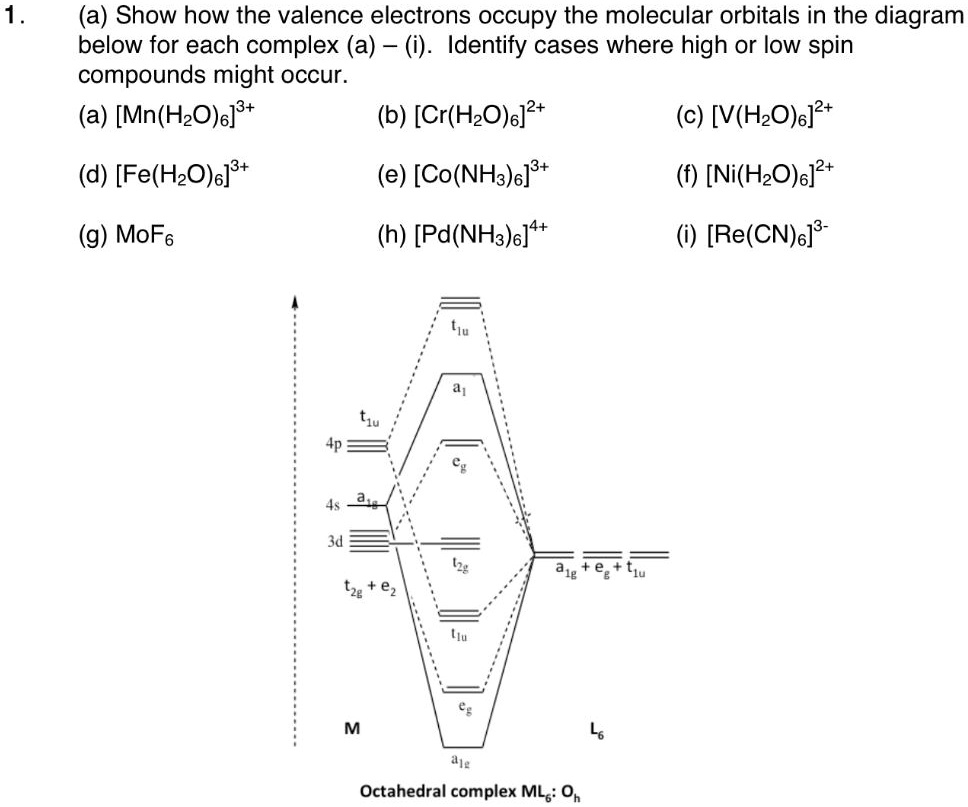
SOLVED Show how the valence electrons occupy the molecular orbitals in the diagram below for
Universitat de València
Ab initio predicted spincrossover (SCO) transitions in a FeNb... Download Scientific Diagram

This is a very narrow viewpoint and leads to lots of mistakes: for example $\ce{[Co(H2O)6]^3+}$ is low-spin although $\ce{H2O}$ is fairly low on the spectrochemical series. In truth it depends on (at least) the ligand, the metal, as well as the oxidation state, and there is no magic formula or rule that allows you to combine all three factors.
Molecular orbitals diagrams of [Ti(H2O)6]3+

Ejemplos de complejos de espín alto y bajo: [Co (H 2 O) 6 2+] contiene un ión metálico d 7 con un ligando de campo débil. Se sabe que este complejo es de alto espín a partir de mediciones de susceptibilidad magnética, que detectan tres electrones desapareados por molécula. Su ocupación orbital es de (t 2g) 5 (e g) 2.
Assertion Cr(H2O)6^3+ is inner orbital complex Reason H_2O is strong ligand generall
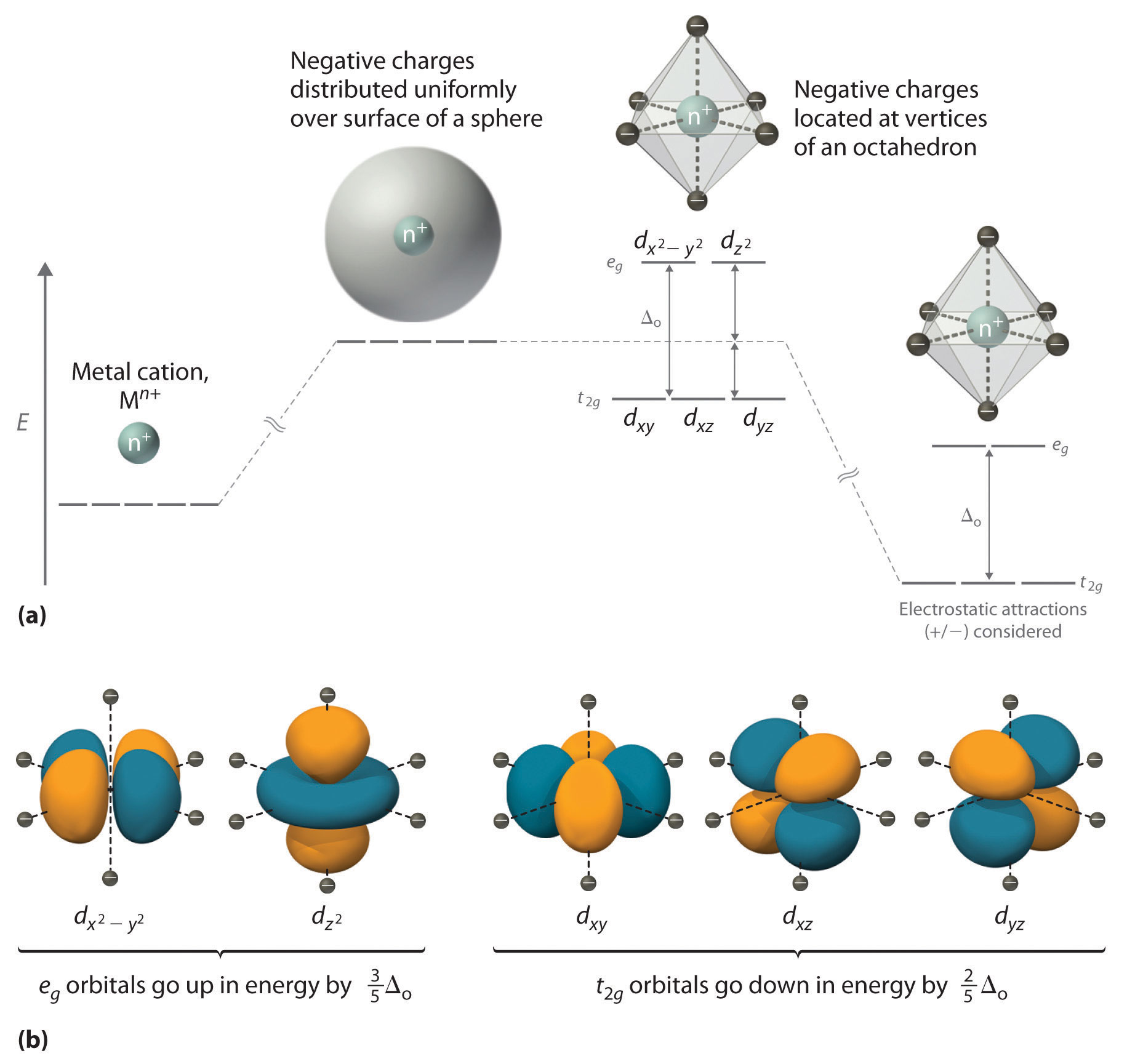
Teoría del campo cristalino. La teoría de campo cristalino (TCC) es un modelo teórico que describe la estructura electrónica de aquellos compuestos de los metales de transición que pueden ser considerados compuestos de coordinación. La teoría de campo cristalino explica exitosamente algunas de las propiedades magnéticas, colores.
[Resuelta] compuestosdecoordinación 18 Regla de los

Esto implica que el número de electrones desapareados en las configuraciones d8, d9 y d10 del ion metálico es, respectivamente, 2 como en [Ni(H2O)6]2+, 1 como en [Cu(H2O)6]2+ y 0 como en [Zn(H2O)6]2+. - La energía de desdoblamiento del campo cristalino (Δo) depende de tres factores: la carga del ion metálico, el número cuántico principal.
.